Introduzione
L’insufficienza cardiovascolare o lo shock, di qualsiasi eziologia, è caratterizzato da una perfusione inefficace dei tessuti corporei, che induce alterazioni dell’equilibrio tra apporto e consumo di ossigeno. La compromissione della disponibilità di ossigeno a livello cellulare provoca uno spostamento verso il metabolismo anaerobico, con un aumento della produzione di lattati e ioni idrogeno che determinano una conseguente acidosi lattica. La quantità di ossigeno disponibile nei tessuti corporei dipende essenzialmente da un adeguato livello di pressione di perfusione tissutale e dalla corretta distribuzione di ossigeno. L’ottimizzazione di questi due parametri fisiologici rappresenta il goal di ogni trattamento pefusivo in grado di ristabilire il corretto equilibrio tra apporto e consumo di ossigeno, riportando così il metabolismo cellulare all’interno dei sui suoi percorsi aerobici. Per tali motivi, la rianimazione emodinamica basa le sue fondamenta sul rapido raggiungimento di adeguati livelli di pressione di perfusione d’organo finalizzati al ripristino di valori fisiologici di saturazione venosa di ossigeno (centrale o mista: SVCO2/SVO2) e sulla risoluzione dell’acidosi lattica e/o dell’iperlattacidemia. Se la noxa patogena o l’alterata distribuzione dell’ossigeno persistono, i disordini metabolici che si sviluppano all’interno delle cellule possono portare alla morte cellulare, al danno d’organo isolato, all’insufficienza multiorgano (MOF) fino alla morte del paziente.
Lo shock
Nei pazienti critici, l’incapacità di mantenere un’adeguata perfusione d’organo provoca disossia cellulare, condizione quest’ultima caratterizzata da un aumento del metabolismo anaerobico finalizzato al mantenimento della produzione di ATP. Il passaggio dal metabolismo aerobico a quello anaerobico dà luogo ad un accumulo di lattati, ioni idrogeno e fosfati inorganici all’interno della cellula che vengono riversati all’interno del torrente ematico dando origine ad un quadro metabolico di acidosi lattica. Dal consensus di società scientifiche che si occupano di pazienti critici, deriva pertanto la nuova definizione di “shock” (o insufficienza circolatoria) intesa come deficit di perfusione tissutale con conseguente aumento dei livelli di lattati e/o una riduzione di SVCO2 o SVO2. Qual è il valore ottimale della pressione arteriosa media?Dal punto di vista fisiologico, sembra ragionevole mantenere valori PAM superiori a 60-65 mmHg, poiché questo rappresenterebbe il punto al di sotto del quale la maggior parte dei letti vascolari perde la capacità di autoregolazione locale. Il cuore, il trasporto globale di ossigeno e la perfusione d’organoUn’adeguata perfusione tissutale e di organo o Gold Direct Therapy (GDT) si realizza attraverso la corretta ottimizzazione della gittata cardiaca (GC) Il cuore rappresenta l’organo principale deputato a trasportare l’ossigeno per consegnarlo alle cellule attraverso il sangue. Il monitoraggio emodinamico ed il ruolo dell’anestesista sono incentrati sul ripristino dell’equilibrio tra ciò che riceve il cuore in termini di volume e riempimento e ciò che lo stesso cuore riesce ad eiettare per destinarlo al circolo periferico. Tale equilibrio trova la sua espressione dinamica attraverso la legge di Frank-Starling: se il ventricolo riceve un volume ematico o di liquidi che eccede la sua capacità di contenimento e di espulsione contrattile di quel momento, le forze contrattili delle miocellule cardiache vengono superate con conseguente depressione della gittata cardiaca ed ipoperfusione periferica. Al contrario, se il cuore possiede capacità espulsive valide, sarà in grado di accogliere importanti volumi ematici e di liquidi tanto da ridistribuirli alla periferia tissutale.

Figura 1 Rapporto tra gittata cardiaca, perfusione d’organo e legge di Frank-Starling
Affinchè si ottenga una corretta perfusione tissutale è inoltre necessario che sia presente una adeguata disponibilità di ossigeno che viene chiamata DO2 E’possibile notare come la disponibilità di ossigeno dipenda dai tre variabili estremamente importanti: Q, Hb, SaO2 dove Q indica il cuore, Hb il sangue e SaO2 l’apparato respiratorio. Questo perché i polmoni permettono il reclutamento di ossigeno, quest’ultimo si lega all’emoglobina e il cuore lo distribuisce in periferia. L’efficienza e l’equilibrio dei tre sistemi garantisce una corretta ed efficace perfusione d’organo.

Figura 2 Rapporto tra DO2, cuore, polmoni e sangue.
Una corretta ed adeguata DO2 ematica permette ai tessuti di estrarre ossigeno per il proprio metabolismo aerobico. Il processo di estrazione o assunzione di ossigeno viene definito VO2 mentre il rapporto tra estrazione e disponibilità di ossigeno viene definito Frazione di Estrazione (02 ER= VO2/DO2) (Figura 3)

Figura 3 Il rapporto tra estrazione e disponibilità di ossigeno viene definito Frazione di estrazione (02 ER= VO2/DO2)
La frazione di estrazione esprime un rapporto cruciale nella perfusione tissutale. Come si evince dalle figure 4 e 5, alla destra della linea indicante la DO2 critica, per certi valori la VO2 è indipendente dalla DO2 e cioè l’estrazione di ossigeno dal sangue non dipende da quanta disponibilità di ossigeno è presente. Questo indica una condizione di normale funzionalità cardiaca, polmonare, ematica e metabolica. In caso di pazienti critici con deficit cardiaci, ematici o polmonari (scompenso cardiaco, insufficienza respiratoria, anemia, MOF) la DO2 si abbassa proiettando il metabolismo in una zona in cui tutta la VO2 dipende da quanta DO2 è disponibile diventando completamente dipendente da essa poiché i meccanismi di compenso cardiaco in termini di gittata sono irreversibilmente alterati prospettando un quadro di Multi Organ Failure (MOF)

Figura 4 DO2 critica ed estrazione di ossigeno
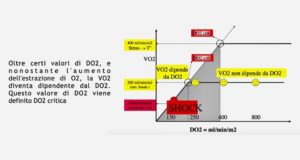
Figura 5 DO2 critica ed estrazione di ossigeno
Come capire se un paziente è in estrazione di ossigeno
L’emogasanalisi con prelievo da catetere venoso centrale per la valutazione della SVCO2 rappresenta un indice molto affidabile di quello che è lo stato di estrazione di ossigeno tissutale. Se si ha a disposizione un catetere di Swan-Ganz è possibile effettuare un prelievo di sangue venoso misto direttamente dall’arteria polmonare per la determinazione della SVO2. I valori di SVCO2 ed SVO2 si aggirano intorno al 60-70% indice del fatto che il paziente non è in fase di estrazione. Nel caso in cui si riscontrino valori più bassi o intorno al 15-35% vorrà dire che il paziente versa in una condizione metabolica di estrazione tissutale di ossigeno e che uno, due o tutti e tre i sistemi di perfusione (Cuore, polmone, sangue) risultano deficitari (Figura 6 e 7)

Figura 6 Limiti della saturazione di ossigeno venosa mista
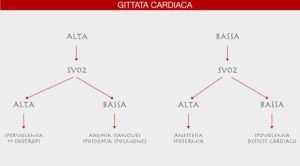
Figura 7 Algoritmo decisionale che lega la gittata cardiaca e la SVCO2/SVO2
Lattati
La condizione in cui il consumo di ossigeno si riduce come diretta conseguenza della progressiva diminuzione del trasporto di ossigeno, coincide con l’aumento della concentrazione di lattati, espressione di ipossia tissutale e di metabolismo anaerobico
Equilibrio acido-base e differenza arterovenosa di CO2
Oltre al suo impatto sulla produzione di lattato, l’ipoperfusione tissutale nel paziente con insufficienza cardiovascolare produce un incremento anionico secondario al metabolismo anaerobico e un difetto di washout di CO2 a livello globale con conseguente alterazione del valore del pH. La differenza artero-venosa della pCO2 è stata considerata un indicatore della capacità del sistema cardiovascolare e del cuore di eliminare la CO2 prodotta nei tessuti periferici. Sulla base delle evidenze fornite, valori di ΔPCO2 superiori a 6 mmHg potrebbero indicare la persistenza di ipoperfusione (Figura 8)
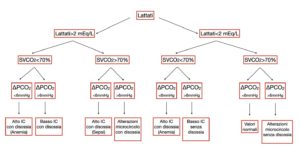
Figura 8 Algoritmo decisionale che correla lattati, SVCO2 e ΔPCO2
Fluid responsiveness
Un eccesso volemico determina l’aumento della domanda del lavoro cardiaco con spostamento a destra sulla curva di Frank-Starling, l’accumulo di liquidi polmonari con aumento del rischio di infezioni e insufficienza respiratoria, l’inibizione della motilità gastrica e un ritardo della guarigione delle ferite. Contrariamente, in condizione di performance cardiaca ottimale, la risposta emodinamica attesa dopo somministrazione di un carico volemico si traduce nell’aumento dello stroke volume e della GC (Figura 9)

Figura 9 Algoritmo decisionale sulla fluid challenge e utilizzo degli inotropi
I livelli di monitoraggio
Esistono 3 livelli di monitoraggio dal più semplice, per la gestione di pazienti non complessi, al più avanzato destinato ai pazienti critici.
Livello I
Uno degli obiettivi più importanti nella gestione del paziente fragile è rappresentato dal mantenimento di una adeguata PAM (>65mmHg) realizzabile anche attraverso il Monitoraggio Emodinamico Predittivo
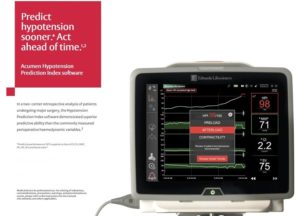
Monitoraggio Emodinamico Predittivo @Edwardslifesciences
La durata e la profondità dell’ipotensione intra-operatoria, caratterizzata da cali critici della pressione arteriosa durante l’intervento, aumenta il rischio della mortalità e delle principali complicanze post-operatorie, come lesioni miocardiche e lesioni renali acute. L’ipotensione intraoperatoria può essere ridotta rilevando in anticipo le possibili cause dell’instabilità emodinamica.

Il dispositivo non invasivo Acumen IQ Cuff di Edwards Lifesciences fornisce in continuo la pressione arteriosa battito-battito e parametri emodinamici avanzati, fornendo una visione dello stato emodinamico dei pazienti. Il monitoraggio non invasivo continuo permette di rilevare e ridurre l’ipotensione intraoperatoria rispetto al monitoraggio intermittente*.
https://www.youtube.com/watch?v=sPPlVJGQGnk
Inoltre, fornisce i seguenti parametri emodinamici avanzati: Hypotension Prediction Index (HPI), dp/dt, Eadyn, Gittata cardiaca (CO), Gittata sistolica (SV), Variazione della gittata sistolica (SVV), Resistenze vascolari sistemiche (SVR). Questi parametri forniscono informazioni utili a determinare la causa principale dell’instabilità emodinamica.
*Maheshwari, K et al. A Randomized Trial of Continuous Noninvasive Blood Pressure Monitoring During Noncardiac Surgery. Anesthesia & Analgesia, 2018 Aug; 127(2)424-431.
Evitare l’ipotensione ed implementare le strategie per ottimizzare la gestione dei fluidi nei pazienti chirurgici sono due fattori modificabili che possono contribuire a migliorare gli esiti dei pazienti. Per saperne di più accedi alla brochure digitale tramite questo link.
Visitate il sito di Clinical Education

Figura 10 Obiettivi del monitoraggio di livello I. TTE/TEE: ecocardiogramma transtoracico/transesofageo; GC/IC: gittata cardiaca/indice cardiaco; CVC: catetere venoso centrale
Livello II
Agli obiettivi del livello I vanno aggiunti ulteriori parametri valutabili attraverso l’utilizzo di software in grado di analizzare la curva della pressione arteriosa cruenta.

Figura 11 Obiettivi del monitoraggio di livello II
Livello III
Agli obiettivi del livello II vanno aggiunti ulteriori parametri valutabili attraverso l’utilizzo di sistemi di monitoraggio avanzati e destinati a pazienti critici destinati ad un trattamento terapeutico rianimatorio

Figura 12 Obiettivi del monitoraggio di livello III
Inoltre, fornisce i seguenti parametri emodinamici avanzati: Hypotension Prediction Index (HPI), dp/dt, Eadyn, Gittata cardiaca (CO), Gittata sistolica (SV), Variazione della gittata sistolica (SVV), Resistenze vascolari sistemiche (SVR). Questi parametri forniscono informazioni utili a determinare la causa principale dell’instabilità emodinamica.
*Maheshwari, K et al. A Randomized Trial of Continuous Noninvasive Blood Pressure Monitoring During Noncardiac Surgery. Anesthesia & Analgesia, 2018 Aug; 127(2)424-431.

Evitare l’ipotensione ed implementare le strategie per ottimizzare la gestione dei fluidi nei pazienti chirurgici sono due fattori modificabili che possono contribuire a migliorare gli esiti dei pazienti. Per saperne di più accedi alla brochure digitale tramite questo link.

Visitate il sito di Clinical Education

Figura 10 Obiettivi del monitoraggio di livello I. TTE/TEE: ecocardiogramma transtoracico/transesofageo; GC/IC: gittata cardiaca/indice cardiaco; CVC: catetere venoso centrale
Livello II
Agli obiettivi del livello I vanno aggiunti ulteriori parametri valutabili attraverso l’utilizzo di software in grado di analizzare la curva della pressione arteriosa cruenta.

Figura 11 Obiettivi del monitoraggio di livello II
Livello III
Agli obiettivi del livello II vanno aggiunti ulteriori parametri valutabili attraverso l’utilizzo di sistemi di monitoraggio avanzati e destinati a pazienti critici destinati ad un trattamento terapeutico rianimatorio

Figura 12 Obiettivi del monitoraggio di livello III
