I colori sono meglio del numero
A cura del dott. Alessio Barile
Anestesia e Rianimazione 2
IRCCS Ospedale «CASA SOLLIEVO DELLA SOFFERENZA», San Giovanni Rotondo
Perché monitorizzare la profondità dell’ipnosi?
L’ anestesia generale causa nel paziente una perdita di coscienza indotta farmacologicamente. Il paziente in anestesia generale è in uno stato di ipnosi, analgesia e rilassamento muscolare.
L’American Society of Anesthesiologists definisce gli standard di monitoraggio minimo per garantire nel paziente in anestesia generale la stabilità e il controllo del sistema cardiovascolare, respiratorio, termoregolatorio e del sistema autonomo (1). Il monitoraggio neurologico non viene indicato tra questi. In molte realtà il livello adeguato di ipnosi in anestesia generale viene valutato osservando parametri fisiologici (frequenza respiratoria, frequenza cardiaca e pressione arteriosa). Tali parametri si sono dimostrati inefficaci e fallimentari in quanto sono risultati frequenti fenomeni quali l’awareness (2).
I sistemi di neuromonitoraggio vengono utilizzati con lo scopo di adeguare il livello di anestesia alle necessità del paziente, in modo da rendere sicura e confortevole la permanenza intraoperatoria.
Data l’elevata variabilità farmacodinamica interindividuale, monitorizzare l’adeguatezza del piano ipnotico permette di scongiurare spiacevoli episodi di superficializzazione in corso di anestesia.
Inoltre un piano ipnotico eccessivamente profondo correla con un aumento della morbilità e mortalità postoperatoria; infatti esso può determinare l’insorgenza di Burst Suppression (profonda depressione dell’attività elettrica corticale) che è un importante fattore di rischio per delirium o disfunzioni cognitive anche a lungo termine (Postoperative Delirium e Postoperative Cognitive Dysfunction).
La dose cumulativa di farmaco somministrato e gli episodi di Burst Suppression si associano ad un risveglio tardivo, ad una prolungata permanenza in recovery room, ad un aumento dei tempi di degenza e ad un peggiore outcome neurologico (3,4).
L’utilizzo del monitoraggio neurologico è perciò finalizzato a garantire un’anestesia di tipo sartoriale, utile soprattutto nel paziente fragile, come pazienti anziani o pazienti con scarsa riserva cognitiva preoperatoria.
Perché utilizzare l’analisi spettrale dell’EEG?
Gli anestesisti utilizzano farmaci che agiscono sul sistema nervoso centrale modificando lo stato di coscienza dei loro pazienti. Per eseguire una valutazione real-time dello stato neurologico dei nostri pazienti, l’anestesista dovrebbe avvalersi di un monitoraggio elettroencefalografico completo ed essere in grado di leggerlo nella sua forma grezza (EEG grezzo o non processato).
Questa competenza però esula dalla preparazione standard dell’anestesista e spesso diviene troppo complessa da attuare in modo ubiquitario in sala operatoria.
Sono stati prodotti perciò moderni dispositivi di monitoraggio neurologico. Essi si basano sostanzialmente sulla rilevazione, tramite elettrodi adesivi frontali, dell’attività elettrica del cervello. Questa viene analizzata da algoritmi, confrontata con un database statistico e infine tradotta in un numero compreso fra zero e cento (Target in anestesia generale 40-60).
Nel corso degli anni ci si è resi conto che tradurre lo stato di coscienza del paziente in un numero è un’eccessiva semplificazione e può portare ad errate interpretazioni (5,6,7,8).
Le principali limitazioni legate all’utilizzo di un indice numerico adimensionale per valutare lo stato di coscienza sono:
- l’utilizzo di componenti più rumorose che interferiscono (ECG, l’elettrobisturi, ecc.)
- l’utilizzo di farmaci come Ketamina o Dexmedetomidina che determinano delle variazioni dell’indice numerico che in entrambi casi non corrispondo con il reale stato di coscienza del paziente;
- la somministrazione di miorilassanti che determinano un decremento dell’indice numerico;
- l’attività di elaborazione del tracciato grezzo e la scrematura dal rumore di fondo richiedono del tempo, che può portare ad un ritardo nella rappresentazione dell’effettivo stato di coscienza.
Queste problematiche vengono superate mediante l’utilizzo del monitoraggio che permette di convertire il tracciato EEG GREZZO (rEEG) sotto forma di intensità cromatiche (SPETTROGRAMMA o Density Spectral Array – DSA).
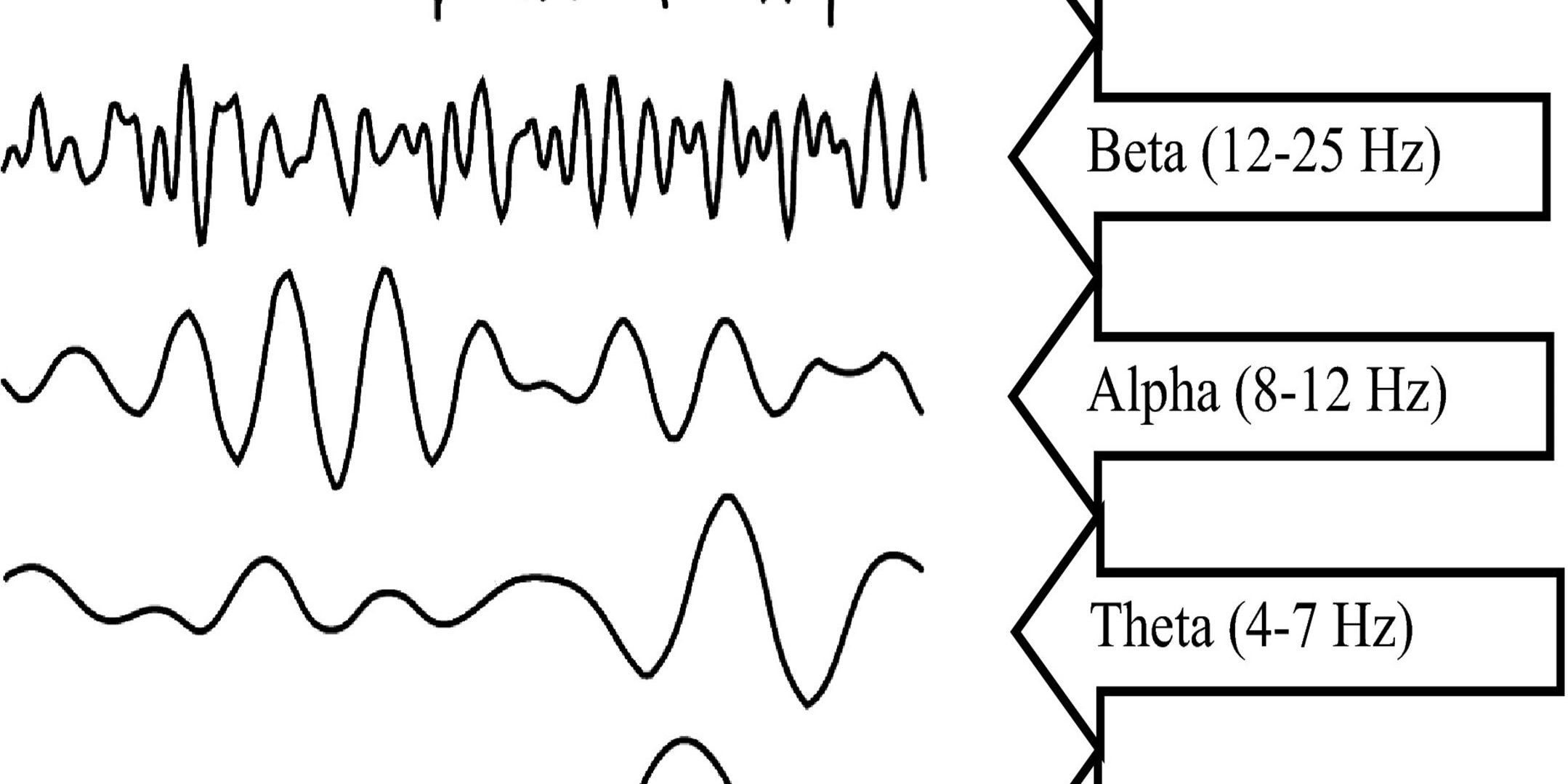
L’EEG GREZZO si caratterizza per la presenza di onde con frequenza e ampiezza diversa, ovvero onde Gamma, Beta, Alpha, Theta, Delta. Queste onde si combinano tra di loro definendo i pattern dei diversi livelli di profondità di anestesia (Figura 1).
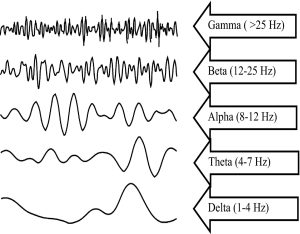
Figura 1. Frequenza delle onde che costituiscono l’Elettroencefalogramma.
L’interpretazione da parte dell’operatore dell’EEG GREZZO può non essere agevole; per questo motivo molti monitor moderni analizzano l’attività elettrica della corteccia frontale generando il DSA. La traccia EEG GREZZA (Figura 2.A) viene scomposta mediante l’utilizzo della trasformata di Fourier nelle sue componenti (Figura 2.B) che sono rappresentate nel grafico (SPETTRO) in cui sull’asse delle x vengono riportate le frequenze e sull’asse delle y le potenze dell’onda (Figura2.C). Lo SPETTRO ha il limite di riassumere informazioni solo per un breve segmento di tempo mentre in sala operatoria si desidera osservare l’evoluzione real-time. Per fare ciò lo spettro viene convertito in un grafico TRIDIMENSIONALE che si chiama SPETTROGRAMMA 3D (Figura2.D).Per ottenere una rappresentazione BIDIMENSIONALE le potenze sono state codificate in colori. Le frequenze a maggior potenza sono evidenziate da colori più caldi (giallo, rosso) mentre quelle a minor potenza sono in blu. Tra rosso e blu abbiamo le onde con rappresentazione intermedia (Figura2.E).
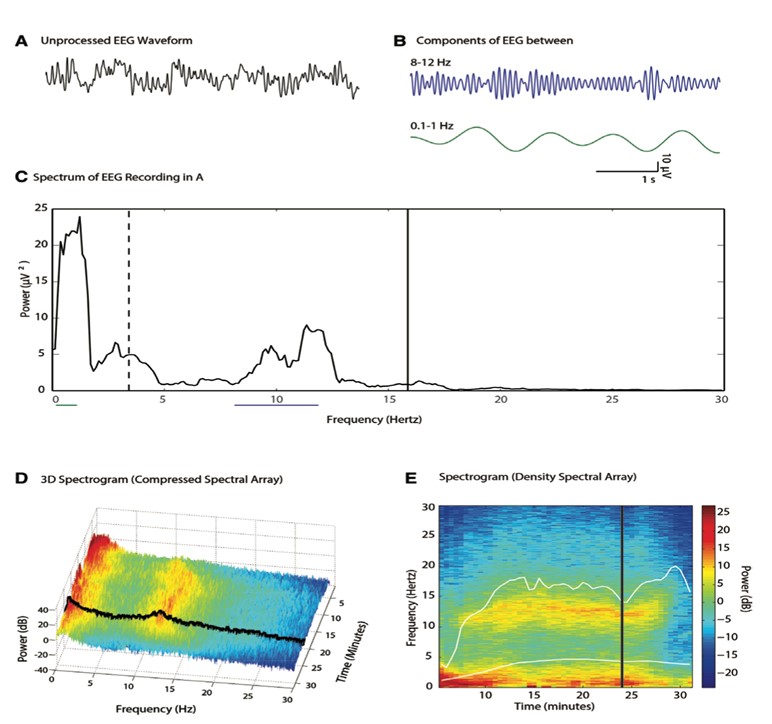
Figura.2 Rappresentazione grafica della trasformazione dell’EEG GREZZO in DSA (tratto da Anesthesiology.015 Oct;123(4):937-60.doi: 10.1097/ALN.0000000000000841.
Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures
Patrick L Purdon 1, et al.)
Il DSA permette di ricavare molte informazioni per quanto riguarda il piano anestesiologico. Esso varia in base al farmaco ipnotico utilizzato in anestesia.
Nella figura 3 sono visibili le due onde predominati di un paziente di 35 anni sottoposto ad anestesia generale con Propofol in infusione continua. In particolare è possibile osservare il pattern tipico per il Propofol:
- La banda rossa sulle basse frequenze Delta (oscillazioni lente a 1Hz)
- L’altra banda rossa sulle frequenze Alpha (8 – 12Hz).
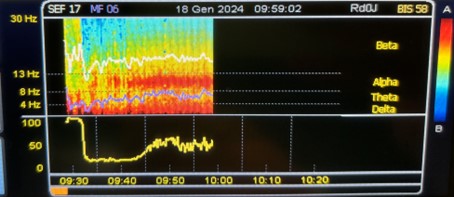
Figura 3. DSA Propofol in paziente di 35 anni.
Lo stesso pattern risulta essere meno evidente nella Figura 4 dove possiamo osservare il DSA di un paziente di 75 anni sottoposto ad anestesia generale con Propofol in infusione continua. Vi è una soppressione delle onde Alpha con mantenimento di una minima componente Delta. Tale pattern può presentarsi nei pazienti anziani e può predisporre allo sviluppo di delirium o disfunzioni cognitive anche a lungo termine (PostOperative Delirium e PostOperative Cognitive Dysfunction).
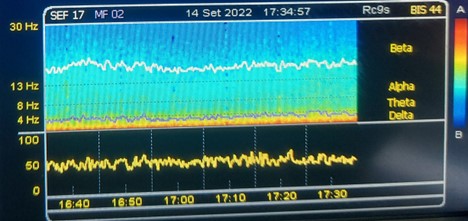
Figura 4. DSA Propofol in paziente di 78 anni.
Possiamo inoltre osservare in Figura 5 come il DSA varia in base all’ipnotico utilizzato. E’ qui rappresentato lo SPETTROGRAMMA della Ketamina .
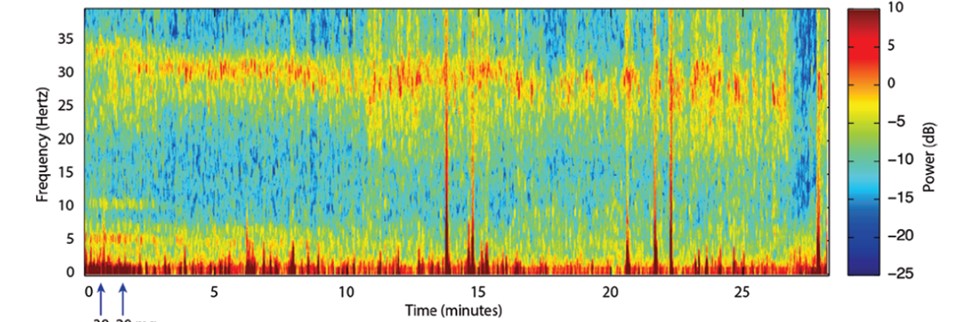
Figura5. DSA Ketamina (tratto da Anesthesiology.015 Oct;123(4):937-60.doi: 10.1097/ALN.0000000000000841.
Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures
Patrick L Purdon 1, et al.)
La Ketamina produce uno stato di eccitazione corticale e sullo spettrogramma questo si riflette con una oscillazione tipica nella regione di frequenza Beta e Gamma.
In figura 6 è descritto lo spettrogramma tipico della Dexmedetomidina. Questo a bassi dosaggi è simile a quello del Propofol ma il ritmo Alpha alto/ Beta basso è molto frammentato (Figura 6.A).
La traccia EEG mostra la comparsa dei tipici fusi (Spindle) del sonno Non-REM2 (Figura 6.B).
In figura 6.C viene utilizzata una dose di Dexmedetomidina più alta. Il ritmo Alpha alto/Beta basso
scompare insieme ai fusi del sonno. Rimangono le oscillazioni nelle basse frequenze intorno ad 1Hz.
La traccia EEG risulta simile a quella del sonno Non-REM3 o del sonno a onde lente (Figura 6.D).
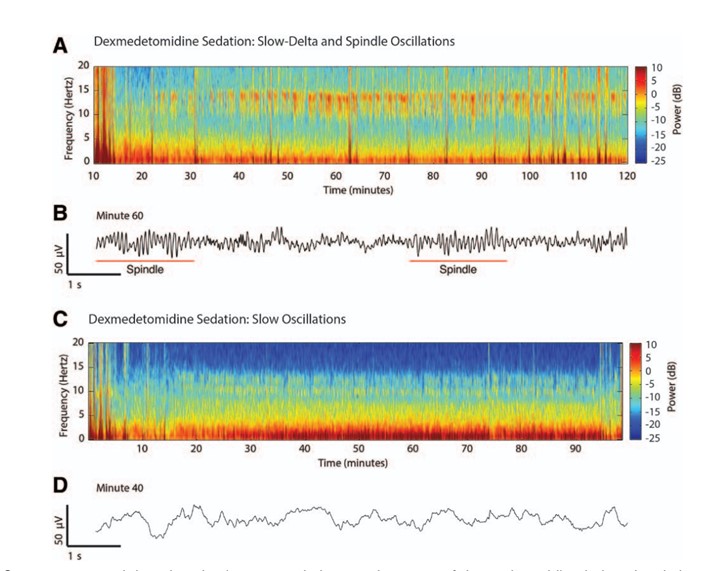
Figura 6. Dsa della Dexmedetomidina (tratto da Anesthesiology.015 Oct;123(4):937-60.
doi:10.1097 /ALN .0000000000000841. Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures Patrick L Purdon 1, et al.)
Un altro strumento utile è lo Spectral Edge Frequency – SEF che indica all’interno di quale frequenza ricade il 95% delle onde elettroencefalografiche. Il SEF viene indicato su ogni spettrogramma sotto forma di numero e linea continua di colore bianco. Quindi osservare un SEF di 12 Hz significa che il 95% delle onde del nostro paziente avranno frequenze pari o inferiori alle Alpha.
Conclusioni
L’anestesista moderno dovrebbe essere in grado di superare la lettura monodimensionale o monoparametrica della profondità dell’ipnosi, imparando così a distinguere onde lente e rapide, frequenze alte e basse, tratti di burst suppression e silenzio elettrico.
La traccia EEG è uno strumento sensibile di monitoraggio real-time.
Lo spettrogramma, che ne rappresenta una forma più immediata di lettura, permette di identificare le variazioni EEG indotte dalle diverse molecole somministrate: traduce in tracciati cromatici peculiari l’effetto di Propofol, Ketamina e Dexmedetomidina.
Lo spettrogramma ci fornisce importanti informazioni circa l’adeguato piano anestesiologico: un intenso binario rosso di onde alpha e delta è il marchio di un’anestesia generale con Propofol ben confezionata.
Ottimizzare le varie fasi dell’anestesia, ossia garantire un piano ipnotico corretto è parte del protocollo ERAS (Enhanced Recovery After Surgery).
Questa modalità di visualizzazione della profondità dell’ipnosi riduce il rischio di errori interpretativi e permette di personalizzare l’anestesia, adeguandola al singolo paziente e al farmaco ipnotico utilizzato.
BIBLIOGRAFIA
- American Society of Anesthesia.Standards for Basic Anesthetic Monitoring.https://www.asahq.org/standards-and-practice-parameters/standards-for-basic-anesthetic-monitoring.Published 2020.
- J.J. Pandit, J. Andrade, D. G. Bogod,et al. The 5th National Audit Project (NAP5) on accidental awareness during general anaesthesia: summary of main findings and risk factors. Anaesthesia. 2014 Oct;69(10): 1089-101.doi: 10.1111/anae.12826.
- Matthew T V Chan , Traci L Hedrick , Talmage D Egan ,et al.American Society for Enhanced Recovery and Perioperative Quality Initiative Joint Consensus Statement on the Role of Neuromonitoring in Perioperative Outcomes: Electroencephalography. Anesth Analg. 2020 May;130(5):1278-1291. doi: 10.1213/ANE.0000000000004502.
- C. Aldecoa, G.Bettelli, Federico Bilotta,et al. Update of the European Society of Anaesthesiology and Intensive Care Medicine evidence-based and consensus- based guideline on postoperative delirium in adult patients. Eur J Anaesthesiol 2024; 41:81–108
- G. Schneider 1et al. Bispectral Index (BIS) may not predict awareness reaction to intubation in surgical patients. Neurosurg Anesthesiol. 2002 Jan;14(1):7-11.doi: 10.1097/00008506-200201000-00002.
- I.F.Russel. The ability of bispectral index to detect intra-operative wakefulness during total intravenous anaesthesia compared with the isolated forearm technique. Anaesthesia 2013, 68, 502–511doi:10.1111/anae.12177.
- I.F.Russel. The ability of bispectral index to detect intra-operative wakefulness during isoflurane/air anaesthesia, compared with the isolated forearm technique. Anaesthesia 2013, 68, 1010–1020 doi: 10.1111/anae.12357
- P. J. Schuller, S. Newell, P. A. Strickland,et al. Response of bispectral index to neuromuscular block in awake volunteers British Journal of Anaesthesia 2015, i95–i103 doi: 10.1093/bja/aev072