Questo mese proponiamo un articolo sul monitoraggio cerebrale in posizione beach chair a cura di
Federica Arturi, Gabriele Melegari, Giuseppe Lubrano
- Università degli Studi di Modena e Reggio Emilia, Scuola di Specializzazione Anestesia e Rianimazione, Terapia Intensiva e del Dolore
- Azienda Ospedaliero Universitaria Policlinico di Modena, Anestesia e Rianimazione II servizio
- Ospedale del Buon Consiglio, Fatebenefratelli, Unità Operativa Complessa Anestesia e Rianimazione,
La posizione “beach chair” sembra innocua: un paziente semi-seduto, un intervento alla spalla, un setting apparentemente controllato.
Ma dietro questa posizione si nasconde una sfida complessa: come garantire ossigeno al cervello quando la gravità lavora contro di noi e l’anestesia tende a far scendere la pressione?
Partiamo da questo caso clinico
- paziente di 77 anni che subisce un trauma alla spalla sinistra, con riscontro di frattura di omero prossimale.
- in anamnesi: cardiopatia ipertensiva (FE all’ultimo ecocardio: 40%), stenosi mitralica moderata, stenosi coronarica severa, pregresso TIA.
- Terapia in atto con antipertensivi e cardioasa.
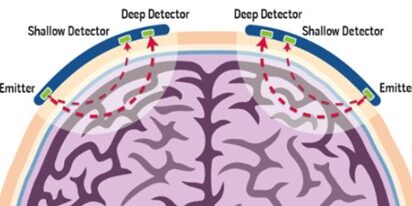
Il paziente viene candidato ad intervento di riduzione della frattura con fissazione interna (ORIF), intervento peculiare in quanto necessita del mantenimento di una posizione semi-seduta, definita “beach chair”. Questa posizione offre diversi vantaggi, in particolare garantisce un posizionamento anatomico della spalla, riduce il rischio di lesioni al plesso brachiale e migliora l’accesso alle vie aeree. [1] Nello stesso tempo comporta diversi effetti avversi, tra cui spiccano quelli neurologici. Si presume che questi siano determinati prevalentemente dal gradiente pressorio che si viene a creare tra il cuore e il cervello a causa degli effetti gravitazionali della posizione seduta, che porta a un’ipoperfusione cerebrale. Questo effetto può essere aggravato ulteriormente dall’effetto ipotensivo dell’anestesia generale, sfruttato per ridurre il sanguinamento intraoperatorio. [2] Da questo deriva la necessità di un monitoraggio della perfusione ed ossigenazione cerebrale, le cui variazioni si sono dimostrate essere direttamente correlate con gli episodi ipotensivi che si verificano durante questa tipologia di interventi. [3] Tra questi monitoraggi, quello principale è rappresentato dall’ossimetria cerebrale o NIRS (Near-Infrared Spectroscopy). Questa misura la saturazione regionale di ossigeno cerebrale (rSO₂), cioè la percentuale di ossigeno nel sangue venoso e arterioso misto del tessuto cerebrale. Il vicino infrarosso (Near-infrared, NIR) rappresenta lunghezze d’onda comprese tra 700 nm e 1000 nm, intervallo in cui il contributo di assorbimento dell’emoglobina ossigenata e deossigenata è massimizzato, mentre il contributo di assorbimento di altri composti come le molecole d’acqua è minimizzato. La luce NIR penetra nel tessuto cerebrale e qui l’attenuazione della luce riflessa fornisce informazioni sulla saturazione regionale di ossigeno cerebrale (rSO2) e sull’equilibrio tra apporto e consumo di ossigeno, rendendo la NIRS una tecnologia molto sensibile ai cambiamenti nell’ossigenazione cerebrale. [4] La tecnologia NIRS non quantifica le molecole di ossigeno, ma calcola il rapporto di assorbimento della luce a lunghezze d’onda predefinite. Fonti di luce esterne possono causare artefatti significativi ed è quindi importante proteggere accuratamente le sonde. In secondo luogo, gli algoritmi utilizzati per calcolare la saturazione di ossigeno presuppongono una distanza fissa che la luce deve percorrere attraverso l’area campionata (la lunghezza del percorso ottico). Tuttavia, i diversi componenti dei tessuti producono quantità molto diverse di dispersione e assorbimento dei fotoni. Di conseguenza, le variazioni nel posizionamento della sonda e le variazioni interindividuali nella composizione dei tessuti possono determinare una variabilità dal 10 al 15% della misura. Infatti, per la NIRS cerebrale, l’influenza del tessuto extracranico e del sangue sulla lunghezza del percorso ottico non è nota. [5, 6] In relazione alla pratica clinica, questo strumento permette di definire la gravità, la frequenza e la durata degli episodi di ipoperfusione, aspetti che risultano direttamente correlati al rischio di ischemia cerebrale e conseguentemente al rischio di sviluppo a lungo termine di deficit neurocognitivi. [1, 7] Nell’intra-operatorio, è fondamentale prima di tutto identificare i valori basali bilaterali, che dovrebbero essere rilevati prima della somministrazione di qualsiasi farmaco o ossigeno, entrambi fattori che potrebbero influenzare tali valori. Quello che si osserva nella pratica clinica è che i valori in genere sono compresi tra il 60% e l’80%. [8] In seguito, ciò che è importante considerare durante la procedura chirurgica è la deviazione percentuale dal valore basale. In particolare, una ipoperfusione cerebrale viene definita come una riduzione tra il 20% e il 25% rispetto ai valori basali o una diminuzione assoluta inferiore al 50%. [9, 10]
In diversi studi è stata dimostrata l’utilità del monitoraggio cerebrale tramite NIRS durante interventi ortopedici di spalla in posizione di beach chair, prevalentemente nell’identificare precocemente e con estrema precisione gli episodi di ipoperfusione cerebrale, direttamente correlati con l’outcome neurologico dei pazienti. [11, 12] Ma il dato impattante è il risultato della comparazione delle rilevazioni NIRS tra pazienti trattati con anestesia generale o loco-regionale: i pazienti trattati con anestesia loco-regionale hanno mostrato un numero significativamente inferiore di episodi di desaturazione cerebrale, risultati significativamente migliori nei test neurocomportamentali il giorno dopo l’intervento e una maggiore stabilità emodinamica nella posizione beach chair rispetto ai pazienti trattati con anestesia generale. Questo a supporto della superiorità dell’anestesia locoregionale nel determinare una migliore gestione intraoperatoria di questi pazienti e un migliore outcome a lungo termine. [13]
Figura 1. Funzionamento monitoraggio NIRS
Bibliografia
[1] Salazar D, Hazel A, Tauchen AJ, Sears BW, Marra G. Neurocognitive Deficits and Cerebral Desaturation During Shoulder Arthroscopy With Patient in Beach-Chair Position: A Review of the Current Literature. Am J Orthop (Belle Mead NJ). 2016 Mar-Apr;45(3):E63-8. PMID: 26991585.
[2] Rains DD, Rooke GA, Wahl CJ. Pathomechanisms and complications related to patient positioning and anesthesia during shoulder arthroscopy. Arthroscopy. 2011 Apr;27(4):532-41. doi: 10.1016/j.arthro.2010.09.008. Epub 2010 Dec 24. PMID: 21186092.
[3] Jeong H, Lee SH, Jang EA, Chung SS, Lee J, Yoo KY. Haemodynamics and cerebral oxygenation during arthroscopic shoulder surgery in beach chair position under general anaesthesia. Acta Anaesthesiol Scand. 2012 Aug;56(7):872-9. doi: 10.1111/j.1399-6576.2012.02716.x. Epub 2012 May 10. Retraction in: Acta Anaesthesiol Scand. 2013 Jan;57(1):133. doi: 10.1111/aas.12033. PMID: 22571277.
[4] Oxiplex T.S. A non-invasive, real-time monitor of precise tissue oxygenation and hemoglobin concentration. [(accessed on 24 February 2020)];Newt. Drive. 2001 6 Available online: http://www.iss.com/biomedical/instruments/oxiplexTS.html
[5] Duncan A, Meek JH, Clemence M, Elwell CE, Tyszczuk L, Cope M, Delpy DT. Optical pathlength measurements on adult head, calf and forearm and the head of the newborn infant using phase resolved optical spectroscopy. Phys Med Biol. 1995 Feb;40(2):295-304. doi: 10.1088/0031-9155/40/2/007. PMID: 7708855.
[6] Kishi K, Kawaguchi M, Yoshitani K, Nagahata T, Furuya H. Influence of patient variables and sensor location on regional cerebral oxygen saturation measured by INVOS 4100 near-infrared spectrophotometers. J Neurosurg Anesthesiol. 2003 Oct;15(4):302-6. doi: 10.1097/00008506-200310000-00002. PMID: 14508170.
[7] Salazar DH, Davis WJ, Ziroğlu N, Garbis NG. Cerebral Desaturation Events During Shoulder Arthroscopy in the Beach Chair Position. J Am Acad Orthop Surg Glob Res Rev. 2019 Aug 2;3(8):e007. doi: 10.5435/JAAOSGlobal-D-19-00007. PMID: 31592504; PMCID: PMC6754215.
[8] Coselli, Joseph S, and Scott A LeMaire. Aortic Arch Surgery : Principles, Strategies, and Outcomes. Chichester, West Sussex ; Blackwell, 2008. Print.
[9] Ali J, Cody J, Maldonado Y, Ramakrishna H. Near-Infrared Spectroscopy (NIRS) for Cerebral and Tissue Oximetry: Analysis of Evolving Applications. J Cardiothorac Vasc Anesth. 2022 Aug;36(8 Pt A):2758-2766. doi: 10.1053/j.jvca.2021.07.015. Epub 2021 Jul 10. PMID: 34362641.
[10] Edmonds HL Jr, Ganzel BL, Austin EH 3rd. Cerebral oximetry for cardiac and vascular surgery. Semin Cardiothorac Vasc Anesth. 2004 Jun;8(2):147-66. doi: 10.1177/108925320400800208. PMID: 15248000.
[11] Pant S, Bokor DJ, Low AK. Cerebral oxygenation using near-infrared spectroscopy in the beach-chair position during shoulder arthroscopy under general anesthesia. Arthroscopy. 2014 Nov;30(11):1520-7. doi: 10.1016/j.arthro.2014.05.042. Epub 2014 Aug 6. PMID: 25108906.
[12] Tange K, Kinoshita H, Minonishi T, Hatakeyama N, Matsuda N, Yamazaki M, Hatano Y. Cerebral oxygenation in the beach chair position before and during general anesthesia. Minerva Anestesiol. 2010 Jul;76(7):485-90. PMID: 20613688.
[13] Aguirre J, Borgeat A, Trachsel T, Cobo Del Prado I, De Andrés J, Bühler P. Cerebral oxygenation in patients undergoing shoulder surgery in beach chair position: comparing general to regional anesthesia and the impact on neurobehavioral outcome. Rev Esp Anestesiol Reanim. 2014 Feb;61(2):64-72. doi: 10.1016/j.redar.2013.08.002. Epub 2013 Oct 9. PMID: 24119783.